Décrypter la cardiomyopathie hypertrophique

Affectant 1 personne sur 500, la cardiomyopathie hypertrophique (CMH) provoque un épaississement de la paroi des ventricules du cœur. «C’est l’une des causes principales de décès subit chez de jeunes patients apparemment en santé et une cause fréquente d’insuffisance cardiaque nécessitant une intervention ou une greffe cardiaque», rapporte le Dr Rafik Tadros, cardiologue et professeur agrégé à la Faculté de médecine de l’Université de Montréal.
Si la maladie est connue depuis les années 1950, les avancées récentes en génomique et l’augmentation de la puissance statistique ont permis de mieux la comprendre. Mais tout n’est pas encore élucidé; avec des collègues de partout dans le monde, Rafik Tadros a ainsi participé à une importante recherche qui s’est penchée sur les causes génétiques de la CMH. Fruit d’une dizaine d’années de travail, leur étude vient tout juste d’être publiée dans la revue Nature Genetics.
Encore beaucoup à comprendre

Même si la CMH a toujours été traitée comme une maladie génétique, on n’est présentement capable d’y associer un gène problématique que dans un cas sur trois. Dans les deux autres tiers, on ne connaît pas sa cause. «Il y a beaucoup de variabilité dans l’expression de la CMH. Par exemple, parmi les patients qui ont un défaut génétique reconnaissable, certains ne développent pas la maladie», note-t-il.
On commence aujourd’hui à comprendre que c’est la combinaison de la génétique avec d’autres facteurs de risque dans la vie (facteurs environnementaux, mode de vie, comorbidités, etc.) qui favorise l’apparition de la maladie. «L’évaluation à la naissance est généralement normale, mais la maladie se développe plus tard et se manifeste à l’adolescence ou à l’âge adulte», précise-t-il.
De plus, aucun traitement spécifique à la CMH n’existe en ce moment. «Ce qu’on traite, ce sont les conséquences de la maladie», indique le Dr Tadros. Aux personnes susceptibles de faire des caillots, on donne un anticoagulant; chez celles à risque d’un arrêt cardiaque, on pose un défibrillateur; chez les individus dont la paroi épaissie obstrue le flux sanguin, on évite le blocage par un médicament ou une chirurgie.
Fouiller la génétique
Pour mieux diagnostiquer et traiter la maladie, il faut donc continuer de fouiller dans la génétique. «On sait maintenant que la CMH est causée par ce qu’on appelle une génétique complexe: ce n’est pas juste une mutation dans un gène qui explique la maladie, ce sont plutôt plusieurs régions du génome qui augmentent le risque d’en souffrir», soutient le Dr Tadros.
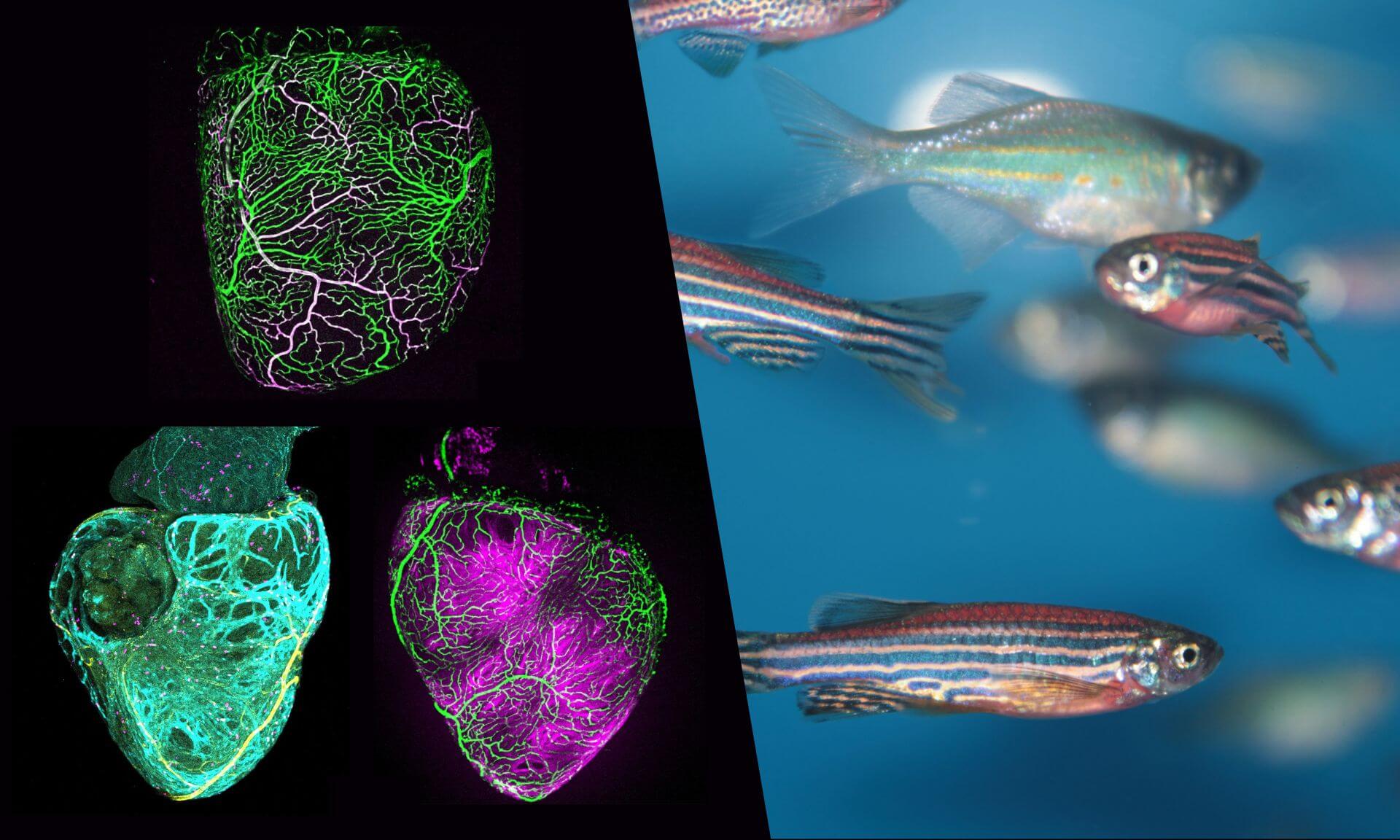
Pour trouver les régions clés dans l’expression de cette maladie, de très grandes cohortes de patients sont nécessaires, d’où le recours à un réseau international de chercheurs et chercheuses des Pays-Bas, des États-Unis, du Royaume-Uni, de l’Italie, de Toronto… et de Montréal. Au total, c’est le génome de quelque 5900 patients atteints de CMH qui a été examiné et comparé avec celui d’un groupe témoin de près de 69 000 personnes. «C’est de loin la plus grande étude d’association pangénomique pour cette maladie», souligne le titulaire de la Chaire de recherche du Canada en génétique cardiovasculaire translationnelle.
L’équipe de recherche a comparé les variants génétiques chez les personnes ayant une CMH par rapport au reste de la population. Elle a désigné 70 régions dans le génome qui étaient associées à la maladie.
Les analyses ont été faites en parallèle au Royaume-Uni et à Montréal pour s’assurer de la robustesse des résultats. L’intelligence artificielle a notamment été mise à profit pour mesurer les dimensions et la fonction du ventricule gauche de même que la fonction cardiaque chez 36 000 individus en santé au moyen de la résonance magnétique cardiaque. Cela a permis de comprendre les déterminants génétiques de la forme et de la fonction du ventricule gauche normal, puis les causes génétiques de la CMH.
Des recherches à poursuivre
«Ça, c’est la première étape. La deuxième, qui prendra probablement de nombreuses années, c’est d’élucider, pour chacune des régions génomiques qu’on a mises au jour, pourquoi elles sont associées à la maladie», avance le Dr Tadros.
La même équipe de recherche a également produit des modèles pour prédire quels individus porteurs de mutations sont susceptibles de développer la maladie ou d’avoir des complications. Ces résultats ont fait l’objet d’un autre article publié simultanément dans Nature Genetics.
Ces études et celles à venir permettront d’approfondir la compréhension de la maladie pour éventuellement mettre au point des traitements et cibler les personnes qui profiteraient le plus de ces thérapies. «Si l’on avait une meilleure façon de prédire qui va souffrir de la maladie et des complications, on pourrait rassurer certains patients et éviter un suivi qui ne serait pas nécessaire si le risque de développer la maladie n’est pas élevé», espère-t-il.