Des chimistes de l’Université de Montréal sous la direction du professeur de chimie Alexis Vallée-Bélisle ont conçu des «cascades de signalisation» constituées de molécules d’ADN qui permettent de détecter et de quantifier la concentration de diverses molécules dans une goutte de sang, le tout en moins de cinq minutes. Leurs résultats, publiés aujourd’hui dans le Journal of the American Chemical Society, pourraient faciliter la mise au point d’appareils de diagnostic de proximité pour surveiller et optimiser le traitement de différentes maladies.
«L’un des facteurs clés du succès thérapeutique est de pouvoir maintenir une concentration optimale du médicament tout au long du traitement, indique le professeur. Une concentration sous-optimale réduit l’efficacité du médicament et conduit souvent à une résistance au traitement, tandis qu’une concentration trop élevée en augmente les effets secondaires.»
Maintenir la bonne concentration de médicaments dans le sang demeure toutefois un défi majeur en médecine moderne. Comme chaque patient possède un profil pharmacocinétique distinct, le dosage le plus approprié varie considérablement d’une personne à l’autre. En chimiothérapie, par exemple, à peine 40 % des patients reçoivent une dose optimale, et il existe peu ou pas de tests assez rapides pour déceler ce problème.
Titulaire de la Chaire de recherche du Canada en bio-ingénierie et bionanotechnologie, Alexis Vallée-Bélisle étudie depuis de nombreuses années la façon dont les systèmes biologiques surveillent en temps réel la concentration des molécules qui les entourent.
«Une des limites importantes des tests de laboratoire actuels, c’est qu’ils comportent des procédures complexes, souligne Vincent De Guire, biochimiste clinique à l’Hôpital Maisonneuve-Rosemont, affilié à l’UdeM, qui n’a pas participé à l’étude. L’échantillon de sang doit être transporté vers un laboratoire centralisé, analysé par du personnel qualifié, puis les résultats sont renvoyés au cabinet du médecin. Si l’on pouvait effectuer ces tests au point de service, voire à domicile, cela permettrait d’optimiser les traitements chimiques en veillant à ce que tous les patients reçoivent la dose thérapeutique idéale.»
Une meilleure façon de surveiller les traitements pharmacologiques à domicile


Comment la découverte s’est produite
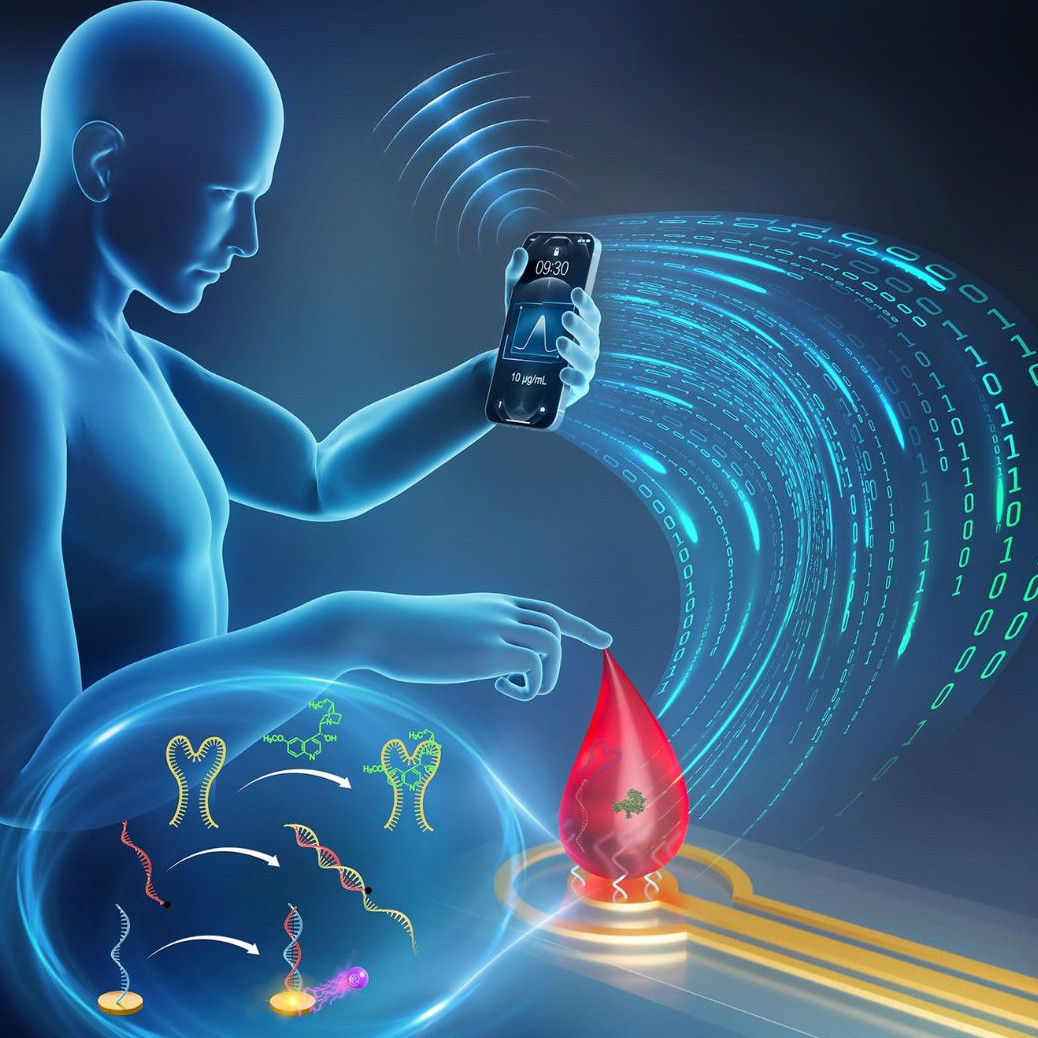
La percée à l’origine de cette nouvelle technologie découle de l’observation des mécanismes par lesquels les cellules détectent et quantifient la concentration des molécules présentes dans leur environnement.
«Les cellules ont mis au point des “cascades de signalisation” nanométriques composées de biomolécules programmées pour activer certaines fonctions cellulaires en réponse à des quantités précises de stimulus ou de molécules externes», explique Guichi Zhu, premier auteur de l’étude et stagiaire postdoctoral à l’UdeM.
Il poursuit: «Inspirés par la modularité des systèmes de signalisation naturels et par la facilité avec laquelle ils évoluent pour trouver de nouvelles cibles moléculaires, nous avons conçu des cascades de signalisation à base d’ADN capables de distinguer et de quantifier des molécules spécifiques grâce à la production d’un signal électrochimique facile à mesurer.»
Le principe de détection de ces capteurs est simple: la molécule cible ou le médicament à surveiller interagit avec une molécule d’ADN spécifique appelée «aptamère». Lorsqu’il se lie à sa cible, cet aptamère ne peut plus inhiber une autre molécule d’ADN électroactive, qui peut alors atteindre la surface d’une électrode et produire un courant électrochimique facilement détectable à l’aide d’un lecteur peu coûteux.
«Un grand avantage de ces tests électrochimiques à base d’ADN est que leur principe de détection peut être généralisé à de nombreuses cibles différentes. On peut donc construire des dispositifs peu coûteux capables de déceler plusieurs molécules en cinq minutes, que ce soit au cabinet du médecin ou à domicile», mentionne Alexis Vallée-Bélisle, dont l’équipe a validé le mécanisme novateur en repérant quatre molécules distinctes dans ce délai.
Testé sur des souris
Pour démontrer comment ce nouveau mécanisme de signalisation pourrait être adapté à un test domestique simple d’utilisation, permettant aux patients de surveiller et d’optimiser leur traitement médicamenteux, les auteurs ont aussi testé la surveillance en temps réel d’un antipaludique chez la souris vivante. Les tests de référence actuellement utilisés pour ce type d’analyse exigent plusieurs heures de manipulation et des instruments coûteux.
Le mécanisme de signalisation d’Alexis Vallée-Bélisle produit une variation de courant électrique suffisante pour être mesurée à l’aide d’un dispositif électronique abordable, analogue à celui des lecteurs de glucose dont se servent les personnes diabétiques.
«Grâce à ce test à base d’ADN, nous avons pu concevoir des capteurs pour plusieurs molécules sanguines, même lorsque leur concentration était parfois 100 000 fois plus faible que celle du glucose», précise Bal-Ram Adhikari, un autre stagiaire postdoctoral de l’UdeM ayant participé à l’étude.
Un brevet pour cette invention a été concédé sous licence à l’entreprise montréalaise Anasens afin d’en accélérer la commercialisation.



